- Health&Medical2025/10/17 21:17
アンジェス、遺伝子治療薬「コラテジェン」を米国で承認申請へ、創業者の森下竜一氏に米国展開の狙いや今後の展望を聞く

アンジェスは、閉塞性動脈硬化症の遺伝子治療薬「コラテジェン」を、2026年内をめどに米国での生物製剤承認申請(BLA)に向けて取り組みを加速している。今年8月に、ドイツの大手製薬企業ベーリンガーインゲルハイムと製造に関する協業を開始。昨年9月には、米国での第II相臨床試験の結果が良好であることを受け、米国FDA(食品医薬品局)からブレイクスルーセラピー(画期的新薬)に指定されている。そこで今回、アンジェス 創業者で医学博士の森下竜一氏に、「コラテジェン」を米国市場で承認申請する狙いや日本市場が抱えている課題、今後の展望について聞いた。
全身の動脈硬化の一つである閉塞性動脈硬化症は、足の血管が詰まることで血流が悪化し、痛みやしびれを引き起こす疾患。全世界で2億人が罹患しているとされ、進行すると潰瘍や壊死を起こし、最悪の場合は下肢の切断に至るケースもあるという。重度下肢切断後の5年死亡率は57%にのぼり、肺がんに次いで死亡率が高いというデータもある。この閉塞性動脈硬化症に対して、“血管を再生させる”という新たなアプローチで足の血流改善を図るのが、アンジェスの開発した遺伝子治療薬「コラテジェン」である。
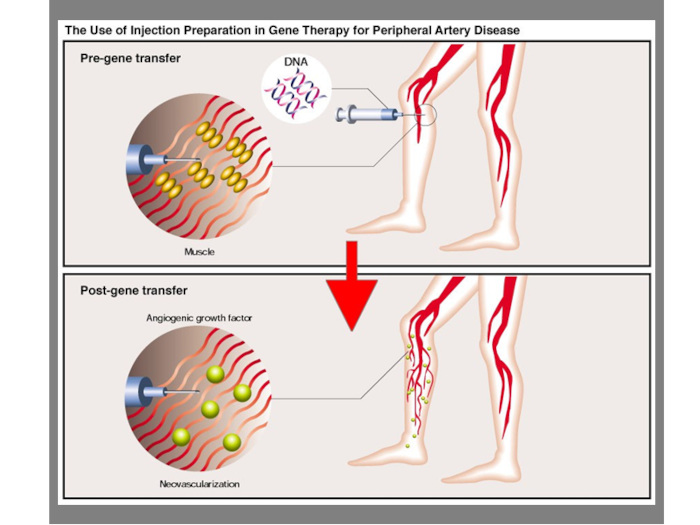
「私は1999年にアンジェスを創業し、日本で発見された『HGF(肝細胞増殖因子)』を活用した遺伝子治療薬の研究開発に取り組んできた。HGFとは、体内で血管の“種”となるタンパク質で、血管新生に深く関わっている。このHGFを作り出す遺伝子(プラスミドDNA)を、筋肉組織に直接投与する治療薬が当社の開発した『コラテジェン』となる。閉塞性動脈硬化症は重症化すると潰瘍ができ、既存の治療法では効果がなくなり、下肢切断を待つしかない状態になる。しかし、『コラテジェン』を患部に投与することで、血管再生が促されて血流が改善し、下肢切断を回避することができる」と、「コラテジェン」による遺伝子治療のアプローチを森下氏が解説してくれた。
「コラテジェン」は、2019年に国内初の遺伝子治療薬として条件・期限付き承認を取得し、国内での販売を開始。その後、昨年6月に日本での承認申請を取り下げ、現在は、米国において生物製剤承認申請(BLA)に向けた準備を進めている。この経緯について森下氏は、「日本では、閉塞性動脈硬化症の重度患者を対象に臨床試験を行い、条件・期限付きで認証を取得した。その後、新型コロナウイルス感染症(以下、新型コロナ)のパンデミックが発生し、世界規模でコロナワクチンが開発されたことで、遺伝子治療の研究が大きく進展。これにともない『コラテジェン』も、米国において重度患者だけでなく軽度患者も含めた大規模な臨床試験が可能になった。そして、この試験結果が非常に良好だったことを受け、日本から米国へ承認申請を切り替えた。閉塞性動脈硬化症の患者数は米国に多く、日本の10倍以上ともいわれている。より多くの患者を救うべく米国市場を優先することを決断した」と説明する。
米国での臨床試験の内容としては、下肢潰瘍を有する閉塞性動脈硬化症を対象とした後期第II相臨床試験を実施。「コラテジェン」を1ヵ月間隔で計4回投与し、初回投与から1年間の経過観察を行った。この結果、プラセボに対して、「コラテジェン」は、下肢潰瘍の完全治癒率が有意に高いことが確認されたという。さらに、第II相臨床試験の結果が非常に優れていること受け、昨年9月には、米国FDAからブレイクスルーセラピー(画期的新薬)に指定された。ブレイクスルーセラピーは、重篤な症状に対する治療薬の開発と審査を迅速化するための制度で、これによって最終段階の第III相臨床試験を行うことなく、早期の承認申請が実現可能となった。
また、米国での承認申請に向けて、8月にドイツの大手製薬企業であるベーリンガーインゲルハイムと「コラテジェン」の原薬製造に関する協業を開始している。「米国FDAでは、新薬の承認にあたり、臨床試験の結果だけでなく、その薬を必要とする患者にしっかり届けられる製造・供給体制を整えていることも重視している。今回、協業を開始したベーリンガーインゲルハイムは、約20年前の臨床試験用の供給から協業を続けており、同社のバイオ医薬品受託製造部門であるBioXcellenceは、高品質かつ大規模な製造体制を持っている。このBioXcellenceが正式に当社の契約開発・製造機関となり、『コラテジェン』の原薬製造および供給を担うことで、承認申請の強力な後押しになると確信している」と、20年越しの製造パートナーであるベーリンガーインゲルハイムと共に、米国での承認申請を加速していくと力を込めた。
もう一つ、日本から米国へ承認申請を切り替えた理由として森下氏は、薬価の問題を挙げる。「医薬品を開発・販売するビジネスの側面からは、薬価も重要なポイントになる。日本では、新薬の価格設定は『原価計算方式』が採用され、開発にかかる費用に比べて薬価が大幅に低くなる傾向がある。一方、米国では、開発費なども含めて、新薬の価格は1000万円以上になるのが当たり前。これは、日本に比べて10倍以上の薬価であり、市場規模も大きいため、新薬開発では米国にアドバンテージがあると考えている」と、日本市場が抱える薬価制度の課題を指摘した。
今後の「コラテジェン」の展望については、「まずは来年、米国における承認申請に向けて全力で取り組んでいく。米国での承認が下りた後は、その試験データや知見を活かして、ヨーロッパでの承認申請を進めていくことを計画している。そして、グローバル展開の中で、薬価問題なども考慮しながら、改めて日本での承認申請も検討していきたいと考えている。将来的には、日本発の遺伝子治療薬を全世界に展開し、日本の創薬ベンチャーとして遺伝子治療のグローバルリーダーを目指す」と意欲を語った。
アンジェス=https://www.anges.co.jp/
- #HGF
- #アンジェス
- #インタビュー
- #コラテジェン
- #ブレイクスルーセラピー
- #ベーリンガーインゲルハイム
- #新型コロナ
- #新薬
- #生物製剤承認申請
- #第II相臨床試験
- #米国
- #米国FDA
- #薬価
- #血管新生
- #遺伝子治療薬
- #閉塞性動脈硬化症